Аспирация клеточных культур
Что такое аспирация клеточных культур?
Аспирация/аспирация — распространенный метод в современных биологических технологиях, таких как клеточная культура, для удаления жидкости. Культивирование клеток включает культивирование эукариотических или прокариотических клеток в контролируемом состоянии, позволяя им расти и размножаться в культуральной среде. Аспирация в лаборатории часто используется для удаления культуральной среды, метаболизирующейся в клеточной культуре, с помощью вакуумного насоса. Вакуумный насос создает отрицательное давление, чтобы перекачивать нежелательную жидкость в бутылки для отходов, не повреждая культивируемые клетки.
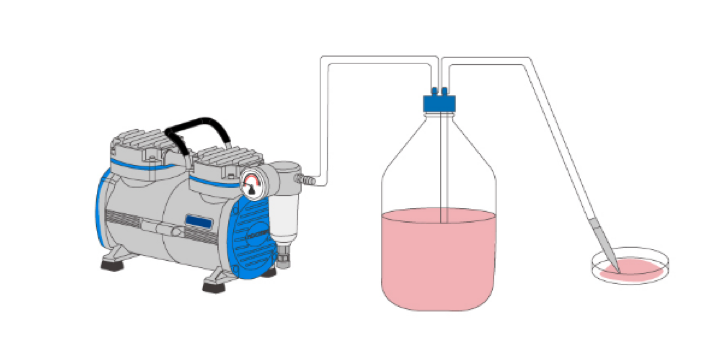
Система вакуумной аспирации клеточных культур для лабораторий часто включает в себя:
А. Вакуумная колба
B. Предохранительная емкость
C. Фильтр
D. Источник вакуума
Когда трубки подключены к источнику вакуума, жидкость будет всасываться в вакуумную колбу из-за разницы давлений. Предохранительная бутылка используется для предотвращения всасывания жидкости в источник вакуума/вакуумный насос. Фильтр может быть любым HEPA (высокоэффективным воздушным фильтром для твердых частиц) или фильтром 0,22 мкм для предотвращения снижения эффективности всасывания частиц.
Основная процедура культивирования клеток
Оттаивание клеток: быстро разморозьте замороженные клетки на водяной бане при 37°C в течение 1 минуты, чтобы предотвратить повреждение клеток.
Культивирование клеток: В зависимости от типа и концентрации клеток, равномерно перемешайте клетки и среду и поместите в инкубатор для культивирования.
Субкультивирование клеток: пассирование относится к разбавлению клеток, достигших высокого слияния, для добавления к клеткам свежей среды, чтобы обеспечить непрерывное размножение культуры.
Пассирование клеток в стационарной фазе не рекомендуется, потому что им, как правило, требуется больше времени, чтобы начать логарифмическую фазу роста после посева. Кроме того, накопление молочной кислоты в плотных культурах может влиять на клеточный метаболизм.
а. Адгезивные клетки, или так называемая монослойная культура
Удалить среду.
Промойте клетки сбалансированным солевым раствором, не содержащим кальция и магния (фосфатно-солевой буфер, сбалансированный солевой раствор Хэнкса и т. д.)
Добавьте отделяющий агент (например, трипсин). Инкубируйте при 37°C до тех пор, пока клетки полностью не отделятся от чашки (2–20 мин в зависимости от клеточной линии).
Ресуспендируйте клетки в свежей среде, тщательно отобрать пипеткой, чтобы получить суспензию отдельных клеток. Если ваша среда не содержит сыворотки, вам необходимо инактивировать отщепляющие агенты, например, путем добавления ингибиторов трипсина. Измерьте общее количество клеток (см. пункт: подсчет клеток).
Проведите посев клетки на новую чашу при желаемой плотности клеток.
b. Суспензионная культура, или так называемая суспензионная культура
Удалите среду и аккуратно ресуспендируйте клетки со сбалансированным солевым раствором. Быстро отцентрифугируйте (150-300 мкг, 3-5 мин) для осаждения клеток.
Удалите солевой раствор и ресуспендируйте клетки в свежей среде. Измерьте общее количество клеток (см.: подсчет клеток).
Пластинчатые клетки на новую чашку при желаемой плотности клеток.
4. Криоконсервация: Ресуспендируйте клетки в среде с 5–10 % ДМСО (диметилсульфоксид) и 30–50 % FBS (фетальная телячья сыворотка) и заморозьте при температуре -80 °C.
5. Подсчет клеток: подсчитайте клетки с помощью камеры Нейбауэра или других автоматических счетчиков, затем рассчитайте концентрацию клеток.
Сравнение лабораторных аспирационных систем
Существует несколько способов проведения аспирации жидкости в лабораториях. В прошлом многие лаборатории использовали пипетку для удаления жидкости, однако это неудобно, а кроме того, в таком способе часто используется большое количество одноразовых трубок, что создает экологические проблемы.
По сравнению с прошлым современные лаборатории отдают предпочтение самоустанавливающимся вакуумным аспираторам. Такая система более эффективна, чем традиционный метод пипетирования, однако плохое расположение трубопроводов, хрупкие стеклянные колбы и трубки могут представлять потенциальную опасность в лаборатории.
Система аспирации серии Lafil представляет собой уникальную интегрированную систему аспирации, в которой источник вакуума сочетается с комплектом для аспирации. Его компактный дизайн экономит больше места на столе, чем другие традиционные модели. Благодаря конструкции платформы, напоминающей забор, он может предотвратить опрокидывание аспирационной бутыли по небрежности пользователя.
Система аспирации ROCKER Lafil
Обработка и утилизация жидких отходов
Органические жидкие отходы, содержащие опасные химические вещества, такие как хлор, следует собирать в соответствующие контейнеры с надлежащей маркировкой.
Неопасную химическую жидкость можно собирать в общий контейнер для отходов для жидкости или масла.
Жидкости, такие как среда для культивирования клеток или супернатанты, должны быть добавлены с соответствующей концентрацией дезинфицирующих средств, таких как отбеливатель (гипохлорит натрия), для уничтожения клеток, а затем слиты напрямую.
Другие биомедицинские отходы, такие как чашки Петри и другие расходные материалы, следует помещать в пакеты для биомедицинских отходов и стерилизовать (автоклавировать) перед утилизацией. Пожалуйста, ознакомьтесь с местными правилами утилизации биомедицинских отходов.
Список рекомендуемых продуктов:
- Для всасывания и фильтрации
- Оптимальна для эксплуатации в ламинарном боксе
- Стерилизация в автоклаве
- Отсутствует загрязнение воздуха, техобслуживание не требуется
- Защита от переполнения Prote™
- Устройство тепловой защиты
- Международные сертификаты безопасности
- Приводится в действие с помощью мембраны
- Отсутствует загрязнение воздуха, техобслуживание не требуется
- Мембранная камера
- Устройство тепловой защиты
- Международные сертификаты безопасности